Keberhasilan yang luar biasa dari teori Bohr diikuti oleh banyak kekecewaan. Pendekatan Bohr ternyata tidak dapat menjelaskan spektrum pancar atom-atom yang mengandung lebih dari satu elektron, seperti helium dan litium. Demikian juga teori Bohr tidak dapat menjelaskan munculnya garis-garis tambahan dalam spektrum pancar hidrogen bila diberi medan magnetik. Masalah ini muncul akibat penemuan bahwa elektron adalah seperti gelombang: Bagaimana “posisi” gelombang dapat ditentukan? Kita dapat menentukan posisi gelombang secara tepat karena gelombang menyebar di dalam ruang.
Dualisme sifat elektron secara khusus menimbulkan masalah karena massa elektron yang sangat kecil. Untuk menguraikan masalah penentuan posisi partikel subatomik yang berperilaku seperti gelombang, fisikawan Jerman Werner Heisenberg merumuskan apa yang sekarang kini dikenal sebagai prinsip ketidakpastian Heisenberg (Heisenberg uncertainty principle): “tidak mungkin untuk mengetahui serentak momentum (massa x kecepatan) dan posisi partikel dengan pasti”. Secara matematis dirumuskan:
dimana Δx dan Δp merupakan ketidakpastian dalam penentuan posisi dan momentum partikel. Dengan kata lain, untuk mendapatkan nilai pengukuran momentum partikel secara tepat maka kita harus mendapatkan posisi partikel dengan kurang tepat atau sebaliknya.
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI
Dengan menerapkan prinsip ketidakpastian Heisenberg pada atom hidrogen, kita dapat mengerti bahwa tidak mungkin mengetahui dengan tepat posisi dan momentum elektron secara bersamaan. Jadi jelas tidak tepat untuk membayangkan elektron mengelilingi inti atom dalam orbit yang ditentukan dengan pasti. Jelas, Bohr telah memberikan sumbangan yang sangat penting bagi pemahaman kita tentang atom, dan saran Bohr bahwa energi elektron dalam atom adalah terkuantisasi belum terkalahkan. Namun teorinya tidak menyediakan deskripsi yang lengkap tentang perilaku elektron dalam atom.
Pada tahun 1926, fisikawan Austria Erwin Schrodinger menggunakan teknik matematika yang rumit, yang merumuskan sebuah persamaan yang menggambarkan perilaku dan energi partikel submikroskopis secara umum, suatu persamaan yang analog dengan hukum Newton untuk gerak benda-benda makroskopis. Namun demikian, penting untuk diketahui bahwa persamaan ini melibatkan perilaku partikel, yang diungkapkan dalam massa m, maupun perilaku gelombang, yang diungkapkan dalam fungsi gelombang, ψ (psi), yang bergantung pada lokasinya di dalam ruang sistem (semacam elektron dalam atom).
Fungsi gelombang sendiri tidak mempunyai makna fisis secara langsung. Namun demikian, peluang untuk menemukan elektron pada daerah tertentu di dalam ruang sebanding dengan kuadrat fungsi gelombang, ψ2. Gagasan untuk menghubungkan ψ2 dengan peluang berasal dari analogi teori gelombang. Menurut teori gelombang, intensitas cahaya sebanding dengan kuadrat amplitudo gelombang, atau ψ2. Tempat yang paling mungkin untuk menemukan foton adalah di daerah dengan intensitas terbesar, yakni tempat dimana ψ2 terbesar. Argumen yang serupa digunakan untuk menghubungkan ψ2 dengan kemungkinana untuk menemukan elektron di daerah sekitar inti atom.
Persamaan Schrodinger memulai era baru di bidang fisika dan kimia, sebab persamaan ini memperkenalkan bahasan baru, mekanika kuantum (juga disebut mekanika gelombang). Kini kita merujuk perkembangan teori kuantum dari tahun 1913-saat Bohr mengemukakan analisanya tentang atom hidrogen-sampai tahun 1926 sebagai “teori kuantum klasik”.
Penanganan Atom Hidrogen dengan Mekanika Kuantum
Persamaan Schrodinger, bila diselesaikan untuk atom hidrogen, menentukan tingkat energi yang mungkin ditempati elektron dan mengindentifikasi fungsi-fungsi gelombang yang berkaitan. Tingkatan energi dan fungsi-fungsi gelombang ini diberi tanda dengan bilangan kuantum. Dengan nilai-nilai bilangan kuantum ini kita dapat membuat model lengkap untuk atom hidrogen.
Walaupun mekanika kuantum menyatakan bahwa kita tidak dapat menunjuk posisi elektron dalam atom, mekanika kuantum mendefinisikan daerah dimana elektron mungkin ditemukan pada waktu tertentu. Konsep kerapatan elektron (electron density) memberikan peluang elektron akan ditemukan pada daerah tertentu dalam atom. Kuadrat fungsi gelombang mendefinisikan distribusi kerapatan elektron di ruang sekitar inti. Daerah dengan kerapatan elektron tinggi menyatakan daerah yang berpeluang tinggi untu ditempati elektron, sedangkan kebalikannya berlaku untuk daerah dengan kerapatan elektron rendah (Gambar 7.15).
Penanganan Atom Hidrogen dengan Mekanika Kuantum
Persamaan Schrodinger, bila diselesaikan untuk atom hidrogen, menentukan tingkat energi yang mungkin ditempati elektron dan mengindentifikasi fungsi-fungsi gelombang yang berkaitan. Tingkatan energi dan fungsi-fungsi gelombang ini diberi tanda dengan bilangan kuantum. Dengan nilai-nilai bilangan kuantum ini kita dapat membuat model lengkap untuk atom hidrogen.
Walaupun mekanika kuantum menyatakan bahwa kita tidak dapat menunjuk posisi elektron dalam atom, mekanika kuantum mendefinisikan daerah dimana elektron mungkin ditemukan pada waktu tertentu. Konsep kerapatan elektron (electron density) memberikan peluang elektron akan ditemukan pada daerah tertentu dalam atom. Kuadrat fungsi gelombang mendefinisikan distribusi kerapatan elektron di ruang sekitar inti. Daerah dengan kerapatan elektron tinggi menyatakan daerah yang berpeluang tinggi untu ditempati elektron, sedangkan kebalikannya berlaku untuk daerah dengan kerapatan elektron rendah (Gambar 7.15).
 |
Figure 7.15 A representation of the electron density distribution surrounding the nucleus in the hydrogen atom. It shows a high probability of finding the electron closer to the nucleus.
|
Untuk membedakan deskripsi mekanika kuantum dari atom
model Bohr, kita
sebut orbital atom
(atomic orbital), bukan
orbit. Orbital atom dapat dianggap sebagai fungsi gelombang dari elektron dalam atom. Bila kita menyatakan bahwa elektron berada dalam orbital tertentu, kita maksudakan distribusi kerapatan elektronnya atau peluang untuk menemukan elektron di dalam ruang digambarkan dengan kuadrat fungsi gelombang yang berhubungan dengan orbital itu. Oleh karena itu, orbital atom mempunyai energi yang khas, dan juga distribusi
kerapatan elektron yang khas.
Persamaan Schrodinger dapat dengan
mudah diselesaikan untuk atom hidrogen yang sederhana yang hanya terdiri dari satu
proton dan satu elektron, tetapi ternyata untuk atom yang mengandung lebih dari
satu elektron persamaan ini tidak dapat diselesaikan secara tepat! Untungnya,
kimiawan dan fisikawan telah belajar mencari jalan keluar lain dari kesulitan
ini dengan metode pendekatan. Sebagai contoh, walaupun perilaku elektron dalam atom
berelektron banyak (many-electron atom) (yakni, atom yang
mengandung dua elektron atau lebih) tidak sama seperti perilaku dalam atom hidrogen,
kita asumsikan perbedaannya mungkin tidak terlalu besar. Jadi kita dapat
menggunakan energi-energi dan fungsi-fungsi gelombang yang diperoleh dari atom hidrogen
sebagai pendekatan yang baik untuk perilaku elektron dalam atom yang lebih
rumit. Ternyata memang pendekatan ini dapat dengan baik memberikan gambaran
perilaku elektron pada atom yang berelektron banyak.
Referensi: Raymond Chang
Referensi: Raymond Chang
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI

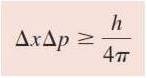
No comments:
Post a Comment