Semua atom dapat
diidentifikasi berdasarkan jumlah proton dan neutron yang dikandungnya. Jumlah
proton dalam inti setiap atom suatu unsur disebut nomor atom. (atomic
number) (Z). Dalam suatu atom netral jumlah proton sama dengan
jumlah elektron, sehingga nomor atom juga menandakan jumlah elektron yang ada
dalam atom. Identitas kimia suatu atom dapat ditentukan cukup berdasarkan nomor
atomnya. Sebagai contoh, Nomor atom nitrogen adalah 7; ini berarti bahwa setiap
atom nitrogen netral mempunyai 7 proton dan 7 elektron. Atau dari sudut pandang
lain, setiap atom di alam yang mengandung 7 proton pasti benar jika diberi nama
“nitrogen”.
Nomor massa (mass number) (A) adalah
jumlah total neutron dan proton yang ada dalam inti atom suatu unsur.
Kecuali untuk bentuk paling umum dari hidrogen yang mempunyai satu proton dan
tidak mempunyai neutron. Secara umum, nomor massa diberikan oleh:
Nomor massa = jumlah proton + jumlah neutron
= nomor atom + jumlah neutron
Jumlah neutron dalam suatu atom sama dengan selisih antara nomor massa dan nomor atom, atau (A – Z). Misalnya, nomor massa fluorin adalah 19, dan nomor atomnya dalah 9 (menunjukkan 9 proton dalam inti). Jadi, jumlah neutron dalam satu atom fluorin adalah 19 – 9 = 10. Perhatikan bahwa ketiga kuantitas (nomor atom, jumlah neutron, dan nomor massa) harus berupa bilangan bulat positif.
Untuk materi kimia lainnya dapat Anda baca pada link berikut: KLIK DI SINI
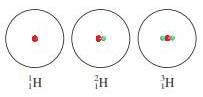
Dalam kebanyakan kasus, atom-atom dari suatu
unsur tertentu tidak semuanya bermassa sama. Atom-atom yang mempunyai nomor
atom yang sama tetapi berbeda nomor massanya di sebut isotop (isotope). Sebagai
contoh, terdapat tiga isotop untuk hidrogen. Isotop pertama, dikenal sebagai
hidrogen, mempunyai satu proton dan tidak mempunyai neutron. Isotop deuterium mempunyai
satu proton dan satu neutron, dan tritium mempunyai satu proton dan dua
neutron. Cara yang lazim digunakan untuk menandai nomor atom dan nomor massa
dari satu atom untuk unsur X adalah sebagai berikut: AZX;
A adalah nomor massa dan Z adalah nomor atom. Jadi, untuk isotop-isotop
hidrogen, ditulis:
Satu contoh lagi,
perhatikan dua isotop uranium yang dijumpai dengan nomor massa berturut-turut
235 dan 238:
23592U
dan 23892U
Isotop pertama
digunakan dalam reaktor nuklir dan bom atom, sedangkan isotop kedua tidak
memiliki sifat-sifat yang diperlukan untuk kedua aplikasi di atas. Terkecuali
untuk hidrogen, isotop unsur-unsur diidentifikasi berdasarkan nomor massanya.
Jadi kedua isotop ini disebut uranium-235 (dibaca “uranium dua tiga puluh
lima”) dan uranium-238 (dibaca “uranium dua tiga puluh delapan”).
Sifat-sifat kimia suatu unsur ditentukan
terutama oleh proton dan elektron dalam atomya; neutron tidak ikut serta dalam
perubahan kimia dalam keadaan normal. Dengan demikian, isotop-isotop dari unsur
yang sama mempunyai sifat-sifat kimia yang sama. Membentuk jenis senyawa yang
sama, dan menunjukkan kereaktifan yang serupa.

No comments:
Post a Comment